Biotecnología roja: qué es, usos clave y retos éticos
La biotecnología roja se ha convertido en uno de los pilares de la medicina moderna. Desde la producción de vacunas y fármacos innovadores hasta terapias génicas y celulares, esta rama de la biotecnología ha transformado la forma de prevenir y tratar enfermedades. A continuación, abordamos en este blog qué es y qué implica la biotecnología roja, sus aplicaciones, avances, desafíos y futuro, con un tono informativo y educativo.
¿Qué es la biotecnología roja?
La biotecnología roja es la rama de la biotecnología enfocada en la medicina y la salud humana.
En términos simples, consiste en la utilización de organismos vivos para desarrollar productos o técnicas que ayudan a prevenir, diagnosticar o curar enfermedades. Su nombre proviene del color de la sangre, en alusión a su objetivo centrado en la salud y la vida humana.
En la práctica, la biotecnología roja abarca todos los usos de la biotecnología en el ámbito sanitario. Esto incluye: la producción de vacunas y antibióticos, el desarrollo de nuevos fármacos, la introducción de técnicas de diagnóstico molecular, las terapias regenerativas y el uso de la ingeniería genética para curar enfermedades mediante la manipulación del ADN. En esencia, siempre que se empleen herramientas biológicas avanzadas para mejorar la salud, estamos hablando de aplicaciones de la biotecnología roja.

¿Cuáles son las principales aplicaciones de la biotecnología roja?
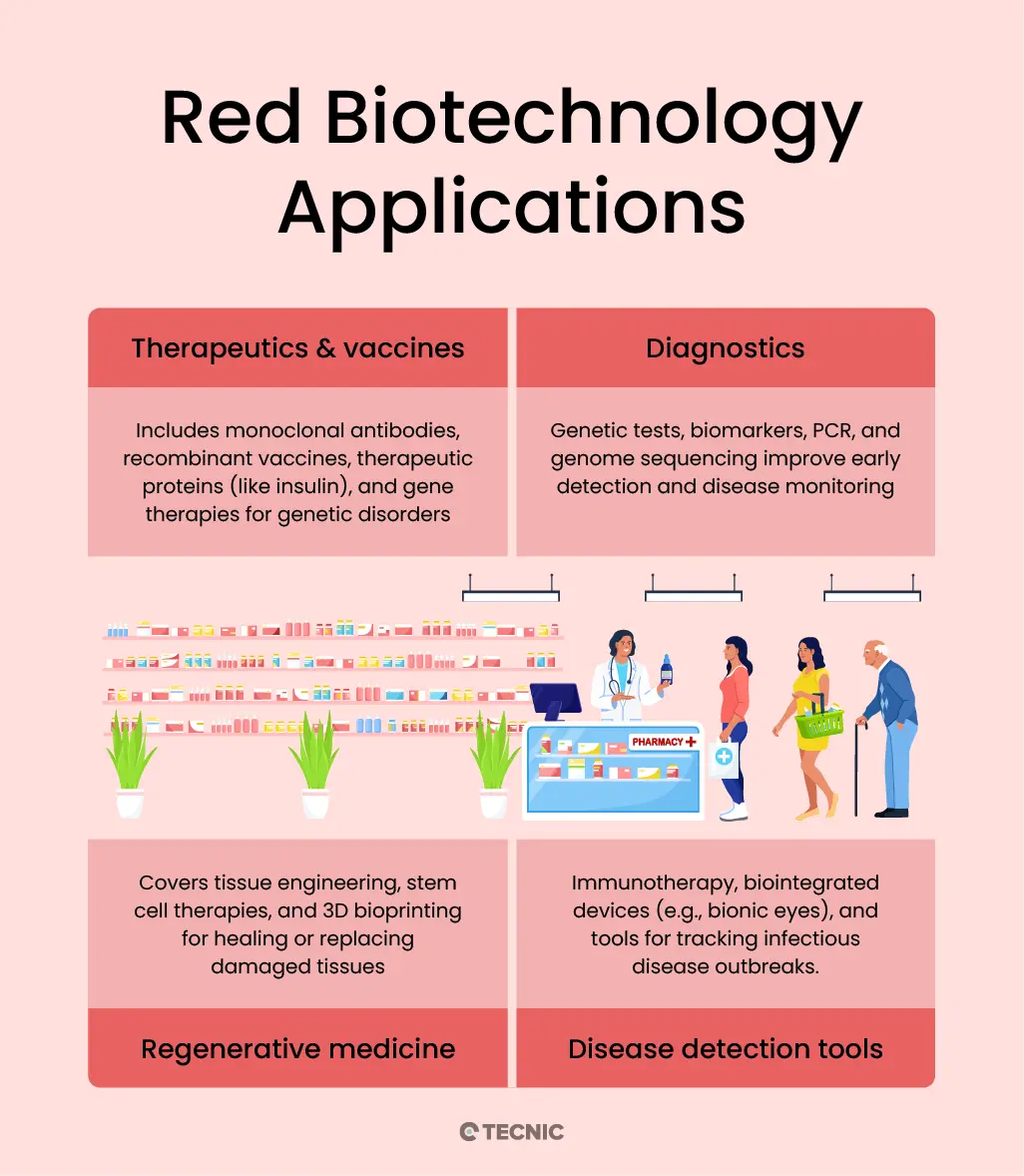
La biotecnología roja se aplica principalmente en terapias y vacunas, diagnósticos, medicina regenerativa y herramientas avanzadas de detección de enfermedades. Estas áreas muestran cómo la biotecnología mejora la atención sanitaria, haciendo que los tratamientos sean más eficaces, los diagnósticos más precisos y las terapias más personalizadas. Su impacto se puede agrupar en varias categorías clave:
- Desarrollo de fármacos y vacunas: La biotecnología roja ha revolucionado la creación de medicamentos. Algunos ejemplos incluyen los anticuerpos monoclonales, proteínas diseñadas para atacar células específicas (muy utilizados contra el cáncer y enfermedades autoinmunes), vacunas recombinantes obtenidas mediante ingeniería genética (más seguras y rápidas de desarrollar que las tradicionales) y proteínas terapéuticas como la insulina humana recombinante para tratar la diabetes. También engloba las terapias génicas, que buscan corregir genes defectuosos para curar enfermedades hereditarias.
- Diagnóstico molecular y genético: Las técnicas biotecnológicas han mejorado enormemente el diagnóstico de enfermedades. Gracias a la biología molecular, hoy disponemos de pruebas genéticas que identifican predisposiciones a padecer ciertas enfermedades, biomarcadores que detectan patologías en etapas tempranas y métodos como la PCR y secuenciación genómica para detectar patógenos o mutaciones de forma rápida y precisa. Por ejemplo, durante la pandemia de COVID-19 se emplearon pruebas PCR para diagnosticar la infección con alta fiabilidad.
- Medicina regenerativa: Es una de las áreas más prometedoras de la biotecnología roja. Incluye la ingeniería de tejidos (cultivar o imprimir en 3D tejidos y órganos para trasplantes), las terapias con células madre (utilizar células troncales para regenerar tejidos dañados) y la bioimpresión 3D de órganos y estructuras biológicas. Estas técnicas están abriendo muchas posibilidades, como la reparación de órganos lesionados, la regeneración de piel, cartílago o hueso, e incluso la futura fabricación de órganos completos para trasplante. Un beneficio palpable de la medicina regenerativa es, por ejemplo, el uso de factores de crecimiento derivados de plaquetas para acelerar la curación de lesiones musculares o ligamentosas en medicina deportiva.
- Otras aplicaciones sanitarias: La biotecnología roja también se aplica en terapias avanzadas como la inmunoterapia (potenciando el sistema inmune para combatir enfermedades), en el desarrollo de prótesis y dispositivos biointegrados (por ejemplo, ojos biónicos o biosensores implantables), y en epidemiología genética para rastrear y contener brotes de enfermedades infecciosas. En definitiva, cualquier campo de la salud donde se empleen organismos vivos o biomoléculas diseñadas para mejorar la salud humana cae dentro de sus aplicaciones.
¿Qué tecnologías y herramientas impulsa la biotecnología roja?
La biotecnología roja se basa en herramientas avanzadas como la edición genética CRISPR-Cas9, la tecnología del ADN recombinante, las terapias génicas y celulares, la bioimpresión 3D, el diagnóstico molecular y la bioinformática con IA. Estas tecnologías de vanguardia han permitido avances antes inimaginables y constituyen la columna vertebral de esta revolución biomédica. Algunas de las herramientas y técnicas más importantes son:
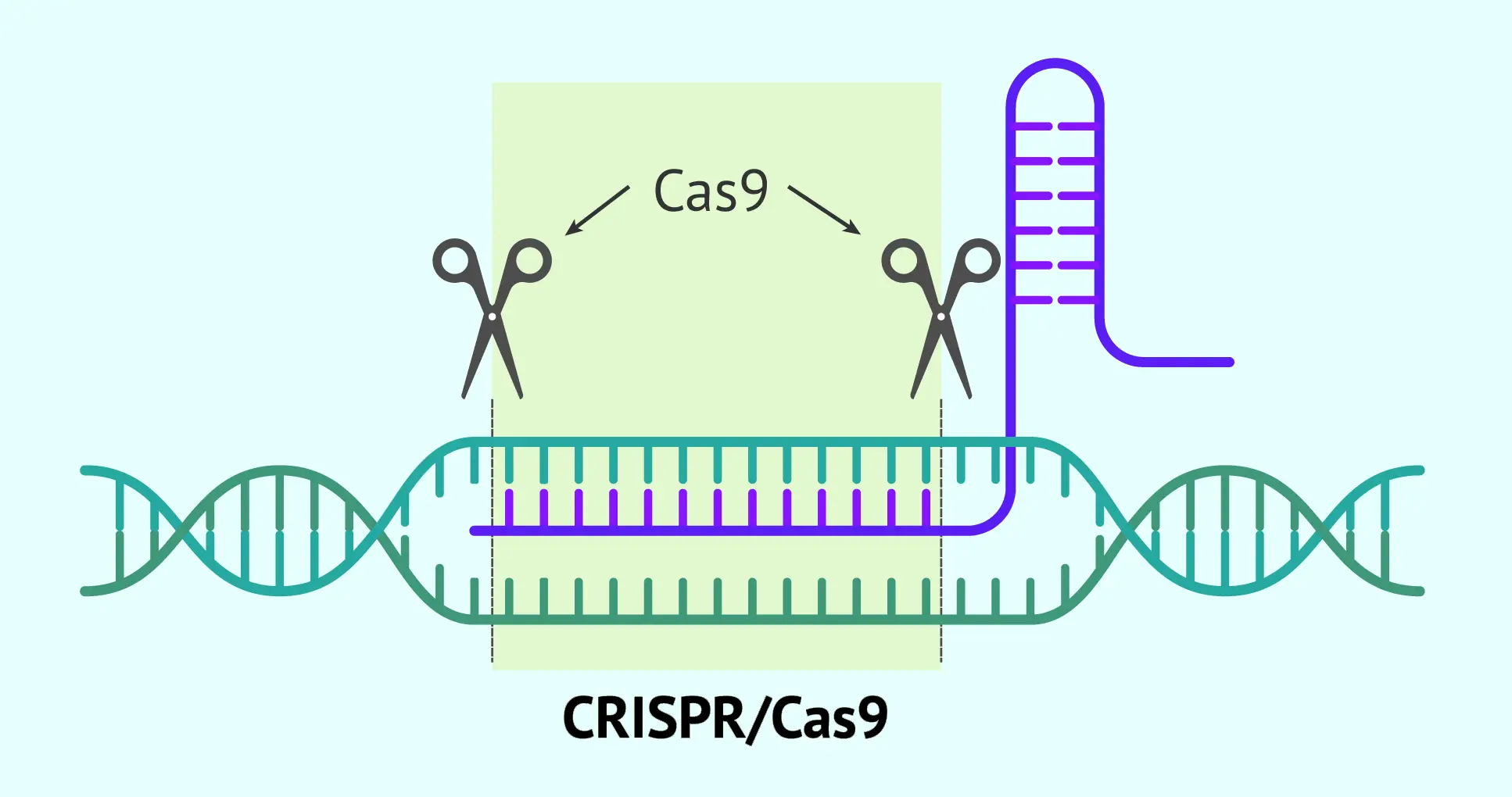
- Edición genética y herramientas de ingeniería genómica: Además de CRISPR/Cas9, existen otras técnicas de edición génica (TALEN, ZFN), pero CRISPR destaca por facilitar modificaciones genéticas de forma rápida y con una precisión sin precedentes. La ingeniería genética abarca también la tecnología de ADN recombinante, utilizada para insertar genes humanos en bacterias u otros cultivos celulares para producir proteínas terapéuticas (por ejemplo, la producción de insulina o anticuerpos en biorreactores). Estas herramientas genéticas permiten desde crear organismos modificados para fabricar fármacos, hasta potencialmente corregir genes en pacientes para curar enfermedades hereditarias.
- Terapias génicas: Aunque relacionadas con la edición genética, se consideran aparte como tecnología médica. Implican el uso de vectores virales u otras plataformas para insertar copias funcionales de genes en las células del paciente. Las terapias génicas actuales usan habitualmente virus desactivados (como adenovirus o virus adenoasociados) modificados para llevar un gen terapéutico. Esta herramienta ha sido crucial en ensayos y tratamientos recientes para hemofilia, atrofia muscular espinal, ciertos tipos de ceguera, etc. Su eficacia depende de avances en biología molecular y virología, que han permitido diseñar vectores cada vez más seguros y específicos. En un futuro cercano, la combinación de terapia génica con edición de base (corrección puntual de mutaciones) promete tratar una variedad aún mayor de enfermedades genéticas.
- Terapias celulares avanzadas: Dentro de este grupo se incluyen tecnologías para manipular células con fines terapéuticos. Un ejemplo es la mencionada terapia CAR-T, posible gracias a técnicas de cultivo celular ex vivo y vectores virales para modificar los linfocitos T del paciente. Otra vertiente son las células madre: las tecnologías de reprogramación celular (para obtener células madre pluripotentes inducidas, iPS) y las técnicas de diferenciación controlada permiten generar células especializadas para trasplantes celulares. Por ejemplo, se están desarrollando células beta pancreáticas derivadas de iPS para tratar diabetes, o neuronas dopaminérgicas para el Parkinson. Estas terapias celulares son viables gracias a herramientas de biología celular y molecular que permiten guiar el destino de las células en el laboratorio antes de implantarlas en pacientes.
- Bioimpresión 3D e ingeniería de tejidos: La impresión tridimensional aplicada a materiales biológicos es una herramienta emergente fascinante. Consiste en usar bioimpresoras 3D que depositan capas de células y biomateriales para crear tejidos u órganos estructuralmente organizados. Combinada con andamiajes de biomateriales, factores de crecimiento y células madre, la bioimpresión permite fabricar, por ejemplo, piel artificial para injertos, parches de tejido cardíaco para reparar infartos, e incluso prototipos de órganos como hígados o riñones a pequeña escala. Aunque aún está desarrollo, esta tecnología promete solucionar en el futuro la escasez de órganos para trasplante, reduciendo las listas de espera y evitando rechazos (al poder usar células del propio paciente). La ingeniería de tejidos, por su parte, emplea andamios y cultivos celulares para regenerar tejidos; ha logrado hitos como la fabricación de vejigas e incluso la construcción de vasos sanguíneos implantables.
- Herramientas de diagnóstico molecular y secuenciación: Tecnologías como la PCR (reacción en cadena de la polimerasa), la secuenciación masiva de nueva generación (NGS) y los microarrays genómicos son fundamentales en la biotecnología roja. Permiten detectar ácidos nucleicos de patógenos, identificar mutaciones genéticas en pacientes y estudiar la expresión génica a gran escala. Por ejemplo, la capacidad de secuenciar genomas enteros de tumores ha dado lugar a diagnósticos genómicos de cáncer para elegir terapias dirigidas, y la secuenciación del ADN fetal en sangre materna permite diagnosticar enfermedades congénitas sin procedimientos invasivos. Estas herramientas, fruto de la biotecnología, han hecho el diagnóstico clínico más temprano, preciso y personalizado que nunca.
- Bioinformática e inteligencia artificial aplicadas a la salud: Si bien no son exclusivas de la biotecnología roja, son aliados cruciales. El manejo de grandes volúmenes de datos biológicos (genomas, proteomas, historiales clínicos) requiere algoritmos y software especializados. La bioinformática permite almacenar y analizar información genética para encontrar dianas terapéuticas y comprender enfermedades.
- Más recientemente, la inteligencia artificial (IA) está acelerando el descubrimiento de fármacos al predecir qué moléculas podrían funcionar como medicamentos o al analizar imágenes médicas para diagnóstico. Según expertos, tecnologías como Big Data, computación en la nube e IA harán los nuevos medicamentos más eficientes y menos costosos, optimizando las etapas de investigación y desarrollo. Un claro ejemplo es el diseño de vacunas por IA o el uso de algoritmos para predecir la estructura de proteínas (como hizo AlphaFold), lo que impacta directamente en la biotecnología médica.
En conjunto, estas tecnologías son las que hacen posible que la biotecnología roja avance a pasos agigantados. La sinergia entre biología y tecnología está impulsando una auténtica revolución en la medicina.
¿Cuáles son los beneficios de la biotecnología roja?
Las principales ventajas de la biotecnología roja son la medicina personalizada, una mayor eficacia de los tratamientos con menos efectos secundarios, un desarrollo más rápido de nuevas terapias, diagnósticos más precoces y precisos, y la posibilidad de tratamientos curativos. La medicina tradicional ha logrado grandes avances, pero la llegada de la biotecnología roja ha ampliado y, en muchos casos, superado esos logros. Algunas de las principales ventajas que ofrece en comparación con los enfoques médicos convencionales son:
- Medicina personalizada y tratamientos a medida: A diferencia de la medicina tradicional, que a menudo aplica tratamientos generales, la medicina moderna permite diseñar terapias específicas para cada paciente en función de su genética y características particulares. Por ejemplo, gracias a pruebas genéticas, hoy es posible seleccionar el fármaco oncológico más efectivo según las mutaciones del tumor del paciente, o dosificar un medicamento según la capacidad de metabolizarlo de su hígado.
Este enfoque de medicina de precisión mejora la eficacia terapéutica y reduce los ensayos de error con fármacos que quizás no funcionarían. La Sociedad Española de Oncología Médica ha calificado a la medicina personalizada como una “revolución” en el tratamiento del cáncer, al permitir elegir terapias según el perfil molecular de cada tumor, logrando mejores resultados para el paciente. - Mayor eficacia y menos efectos secundarios: Los tratamientos biotecnológicos suelen actuar a nivel molecular muy específico, lo que aumenta la eficacia y disminuye los daños colaterales. Terapias dirigidas como anticuerpos monoclonales se unen solo a células o moléculas diana, evitando afectar tejidos sanos (a diferencia, por ejemplo, de la quimioterapia tradicional que daña células sanas). Esto se traduce en menos efectos secundarios y riesgos para el paciente. Asimismo, vacunas modernas inducidas (como las de ARNm) generan respuestas inmunes fuertes sin contener patógenos completos, mejorando el perfil de seguridad.
- Desarrollo más rápido de nuevas terapias: Históricamente, desarrollar un nuevo medicamento podía llevar más de una década. Hoy, gracias a técnicas biotecnológicas, el proceso se ha acelerado. Un claro ejemplo fue la rápida obtención de vacunas contra COVID-19 en menos de un año, posible gracias a plataformas de ARNm y vectores virales ya investigadas. Actualmente, la biotecnología ofrece la posibilidad de producir vacunas y tratamientos de forma mucho más rápida ante amenazas emergentes. Las plataformas “plug-and-play” (como las de ARNm) permiten adaptar con velocidad un diseño básico a diferentes enfermedades, algo impensable con métodos tradicionales. Esto significa que ante nuevas pandemias u otras emergencias de salud, estamos mucho mejor preparados para responder con rapidez. Además, herramientas como la biología computacional y la IA agilizan la identificación de moléculas prometedoras y el diseño de fármacos, recortando tiempo y costos en I+D.
- Diagnóstico temprano y preventivo: La biotecnología roja ha mejorado no solo los tratamientos, sino también la prevención. Técnicas moleculares ultra-sensibles permiten detectar enfermedades en fases iniciales, cuando aún son más fáciles de tratar o incluso curar. Por ejemplo, pruebas de ADN fetal no invasivas pueden diagnosticar desórdenes genéticos en el feto sin necesidad de amniocentesis arriesgada; análisis de biomarcadores pueden descubrir un cáncer cuando todavía es microscópico. Esto conlleva diagnósticos más precisos, rápidos y asequibles que en la medicina tradicional. En el terreno preventivo, conocer la predisposición genética a ciertas enfermedades (mediante pruebas de genómica personal) permite tomar medidas anticipadas, desde cambios en el estilo de vida hasta vigilancia médica estrecha, para evitar o mitigar enfermedades antes de que se manifiesten.
- Tratamientos curativos en lugar de paliativos: Quizás el beneficio más revolucionario es que la biotecnología roja ofrece la esperanza de curar enfermedades, no solo controlarlas. Muchas terapias tradicionales se enfocan en aliviar síntomas o frenar la progresión (por ejemplo, insulina controla la diabetes, pero no la cura; antirretrovirales controlan el VIH, pero el virus persiste). En cambio, las nuevas terapias génicas o celulares apuntan a eliminar la causa subyacente de la enfermedad. Si un niño con atrofia muscular espinal recibe un gen faltante y ya no desarrolla la enfermedad, o un paciente con leucemia es tratado con sus propias células reprogramadas y queda libre de cáncer, estamos ante curaciones reales. Si bien estos tratamientos son costosos y complejos, su impacto es enorme: se justifica su alto coste porque suelen ser tratamientos únicos y curativos, tras los cuales el paciente ya no necesitará medicamentos de por vida. Esto contrasta con el paradigma tradicional de medicar crónicamente. En términos de salud pública, curar enfermedades congénitas o mortales no solo salva vidas, sino que a largo plazo puede reducir gastos sanitarios (al evitar años de tratamientos continuos). La posibilidad de erradicar enfermedades hereditarias o ciertos cánceres gracias a la biotecnología roja es un beneficio sin precedentes.
En resumen, la biotecnología roja potencia la medicina en todos sus frentes: hace los tratamientos más personalizados, efectivos y seguros, acelera la innovación terapéutica, permite anticipar y prevenir enfermedades, y abre la puerta a curaciones definitivas en vez de tratamientos meramente paliativos. Supone un cambio de enfoque, de una medicina reactiva y generalizada hacia una medicina proactiva, de precisión y resolutiva, adaptada a cada individuo y capaz de atacar las enfermedades en su raíz.

¿Cuáles son los desafíos éticos y regulatorios de la biotecnología roja?
Los principales retos éticos y normativos de la biotecnología roja son la edición genética en embriones, el acceso desigual a terapias costosas, las preocupaciones sobre la seguridad a largo plazo, las disparidades normativas a nivel mundial y la privacidad de los datos genéticos. A pesar de sus inmensos beneficios, la biotecnología roja se enfrenta a importantes obstáculos éticos y normativos que deben abordarse con cautela. Algunos de los principales retos son:
- Edición genética hereditaria y “bebés de diseño”: La posibilidad de modificar genes en embriones humanos (línea germinal) plantea profundas cuestiones éticas. Tecnologías como CRISPR han hecho técnicamente viable alterar el ADN de un embrión, lo que implica que esos cambios pasarían a las siguientes generaciones. Esto genera el temor a un futuro de “bebés a la carta”, donde se seleccionen o editen rasgos no solo para evitar enfermedades, sino por preferencias (color de ojos, altura, capacidades). La comunidad científica y la sociedad en general debaten dónde trazar la línea entre terapias para curar enfermedades graves y modificaciones con fines de “mejora” o estéticos, que podrían comprometer la diversidad humana y nuestra ética. Actualmente existe consenso en prohibir la edición genética germinal clínica, pero casos como el de los bebés CRISPR en China (2018) evidencian la realidad de este riesgo. El desafío es establecer marcos éticos globales: ¿Debemos o no permitir modificaciones heredables? ¿Quién decide qué es aceptable editar? La responsabilidad que conlleva “jugar a ser Dios” con nuestro código genético es un tema sensible que la biotecnología roja ha puesto sobre la mesa.
- Disparidades regulatorias y turismo genético: Las leyes y regulaciones sobre biotecnología varían mucho por país. Algunos lugares tienen normativas estrictas para terapias génicas, edición genética o clonación, mientras otros son más laxos. Esto crea la posibilidad de “turismo genético”, donde pacientes viajan a países con menos restricciones para someterse a tratamientos genéticos no aprobados en su país. Por ejemplo, aunque la edición de embriones está prohibida en la mayoría de naciones desarrolladas, podrían surgir clínicas en lugares con vacíos legales ofreciendo estos servicios, con potenciales riesgos sanitarios y éticos. La falta de un marco regulatorio internacional unificado dificulta controlar estas prácticas. Un desafío importante es coordinar esfuerzos globales para evitar abusos biotecnológicos, establecer estándares de seguridad y ética compartidos, y prevenir que la regulación fragmentada derive en experimentación peligrosa o en inequidades (solo quienes pueden viajar acceden a ciertas terapias).
- Seguridad y consecuencias a largo plazo: Muchas de las intervenciones de la biotecnología roja son relativamente nuevas, y sus efectos a largo plazo no se conocen por completo. Existe preocupación por posibles impactos imprevistos: por ejemplo, una terapia génica podría, en teoría, causar mutaciones inadvertidas años después, o células modificadas podrían desencadenar problemas inmunológicos. Debido a este desconocimiento de consecuencias a largo plazo, la biotecnología ha sido blanco de críticas y llamados a la precaución. Para mitigar esto, los ensayos clínicos de terapias avanzadas son muy rigurosos y prolongados, y los pacientes tratados suelen ser monitoreados de por vida en registros especiales. Aun así, el dilema ética-ciencia persiste: ¿hasta qué punto es aceptable correr riesgos en nombre de una posible cura? ¿Cómo aseguramos la seguridad sin frenar la innovación? Las agencias regulatorias (FDA, EMA, etc.) enfrentan el reto de evaluar estas terapias con métodos adecuados, y a veces deben tomar decisiones con datos aún limitados. Encontrar el equilibrio entre proteger a los pacientes y no entorpecer avances prometedores es un desafío constante.
- Costo y acceso equitativo a las terapias: Muchas terapias biotecnológicas son extraordinariamente costosas de desarrollar y producir, lo que se traduce en precios altísimos por tratamiento. Por ejemplo, terapias génicas y celulares suelen costar del orden de $1 millón (o más) por paciente, llegando en casos como el de Hemgenix (terapia génica para hemofilia) a 3,5 millones de dólares por dosis. Estos precios desorbitados plantean serios dilemas: los sistemas de salud, incluso en países ricos, difícilmente pueden asumir su financiación para todos los pacientes que las necesitan. Ya se han visto situaciones donde aseguradoras privadas niegan cobertura, o empresas retiran terapias del mercado de ciertas regiones por disputas de precio (como ocurrió con una terapia génica para beta-talasemia en Europa). Desde el punto de vista ético, surge la pregunta de quién podrá acceder a estas curas milagrosas: ¿solo los muy adinerados o quienes viven en países desarrollados? Existe el riesgo de ampliar la brecha sanitaria entre ricos y pobres si las innovaciones quedan fuera del alcance de la mayoría. Esto ha llevado a debates sobre nuevos modelos de negocio (pago por resultados, financiación pública de desarrollos, liberalizar patentes tras cierto tiempo, etc.). El desafío es lograr que los frutos de la biotecnología roja sean accesibles y sostenibles, sin desincentivar la inversión privada necesaria para su desarrollo. La comunidad internacional, gobiernos y compañías deberán colaborar para resolver cómo abaratar costos (por ejemplo, automatizando procesos de fabricación de terapias celulares) y cómo regular precios de modo justo, de forma que la capacidad de salvar vidas de estas terapias no se vea limitada por consideraciones económicas.
- Cuestiones de privacidad y uso de datos genéticos: Otro aspecto ético-regulatorio es el manejo de la información genética de las personas. A medida que las pruebas genómicas se popularizan (secuenciación del exoma/genoma, test de riesgo genético, etc.), surge la preocupación de quién controla y accede a esos datos. Existe el riesgo de discriminación genética (por ejemplo, aseguradoras o empleadores que pudieran usar información genética en contra de individuos) o de brechas de privacidad si las bases de datos genéticos no son seguras. Países como EE.UU. tienen leyes (GINA) que prohíben la discriminación por factores genéticos, pero no en todo el mundo existe un marco así. Asegurar la confidencialidad de los datos médicos y genéticos de los pacientes y delimitar usos aceptables (investigación, diagnóstico) de los no aceptables es un desafío que acompaña el auge de la medicina genómica dentro de la biotecnología roja.

¿Cómo será el futuro de la biotecnología roja?
El futuro de la biotecnología roja incluye terapias genéticas y celulares curativas, órganos cultivados en laboratorio y medicina regenerativa, tratamientos personalizados impulsados por la inteligencia artificial y nuevos marcos éticos para el acceso global. El futuro de la biotecnología roja es muy prometedor y apunta a un panorama en el que la medicina seguirá avanzando rápidamente. Algunas perspectivas y tendencias incluyen:
- Curas para más enfermedades: En las próximas décadas, es esperable que veamos consolidarse las terapias génicas y celulares que hoy están en sus inicios. Esto podría traducirse en la eliminación de enfermedades hereditarias, por ejemplo, la fibrosis quística o la anemia falciforme, corrigiendo sus mutaciones antes de que causen daño. Asimismo, se confía en curar infecciones crónicas como el VIH mediante ediciones genéticas que confieran resistencia al virus, o en llevar la inmunoterapia del cáncer a un punto tal que muchos cánceres sean controlables o curables como enfermedades crónicas. La biotecnología roja ya ha aumentado la esperanza de vida global al proporcionar tratamientos contra enfermedades mortales, y a futuro esa esperanza de vida podría extenderse aún más si enfermedades hoy letales se vuelven tratables. También emergerán nuevas soluciones a viejos problemas médicos: por ejemplo, nuevos antibióticos o alternativas frente a bacterias resistentes, usando enfoques biotecnológicos que eviten la resistencia (como bacteriófagos diseñados o moléculas que inhiban resistencia). En síntesis, podemos anticipar una disminución significativa de la carga de enfermedades actualmente incurables, gracias a terapias nacidas de la biotecnología.
- Medicina regenerativa y trasplantes: Es plausible que en el futuro cercano veamos avances increíbles en la creación de tejidos y órganos a la carta. La combinación de células madre, bioimpresión 3D y edición genética podría permitir generar órganos funcionales en laboratorio listos para trasplante, por ejemplo, hígados o riñones bioartificiales personalizados para el receptor. Esto solucionaría la escasez de donantes y el problema del rechazo inmunológico (si los órganos se crean con las propias células del paciente). Incluso antes de lograr órganos completos, ya se vislumbra el uso de xenotrasplantes: órganos de animales modificados genéticamente para ser compatibles con humanos. Recientemente se han hecho trasplantes experimentales de riñón y corazón de cerdo a humanos con cierto éxito, gracias a la edición genética que elimina moléculas porcinas causantes de rechazo. En el futuro, disponer de cerdos donantes de órganos para humanos podría volverse rutinario, aliviando enormemente las listas de espera. Por otro lado, la regeneración in situ de órganos dañados mediante terapias génicas es otra vía: por ejemplo, activar la regeneración del tejido cardíaco tras un infarto con vectores adecuados. En definitiva, el futuro apunta a una medicina donde el cuerpo pueda repararse o reemplazarse, prolongando así la vida saludable.
- Integración de la medicina con tecnología digital y datos: La biotecnología roja en el futuro estará aún más entrelazada con disciplinas como la informática, la electrónica e incluso la nanotecnología. La medicina personalizada alcanzará su máximo potencial: antes de tratar a un paciente, quizá se secuenciará su genoma completo al nacer, se almacenará en su historial y se usarán algoritmos de IA para predecir qué enfermedades podría desarrollar y cómo prevenirlas. Los tratamientos podrán adaptarse no solo al genoma, sino también al microbioma del paciente, a su proteoma, etc., una verdadera medicina de sistemas. La inteligencia artificial jugará un rol clave identificando patrones en enormes bases de datos clínicos-genómicos para descubrir nuevas dianas farmacológicas o correlaciones que ni imaginamos. También podríamos ver dispositivos médicos biotecnológicos: biosensores implantables que monitoreen constantemente parámetros sanguíneos (glucosa, células tumorales circulantes, marcadores inflamatorios) y que avisen de problemas de salud antes incluso de que haya síntomas. Esto permitiría una prevención muy temprana. La telemedicina unida a estos biosensores y a análisis genéticos significará un cuidado continuo, no solo visitas reactivas al médico. Además, la IA combinada con robótica podría automatizar procesos complejos de laboratorio (síntesis de genes, selección de clones celulares, manufactura de terapias) abaratando costos y democratizando el acceso
En conclusión, podemos imaginar el futuro de la biotecnología roja como una época de auténtica revolución biomédica. Esta disciplina ya ha transformado nuestra salud y esperanza de vida en las últimas décadas, y todo indica que su papel será aún más determinante en los años por venir. El desafío será ir avanzando con responsabilidad, pero con la vista fija en ese horizonte de una humanidad más sana.
Conclusión
La biotecnología roja no solo está transformando la medicina, sino que está redefiniendo nuestra forma de entender la salud y la enfermedad. Desde terapias innovadoras que curan trastornos genéticos hasta herramientas de diagnóstico que detectan enfermedades antes que nunca, este campo está impulsando una nueva era de atención sanitaria personalizada, precisa y regenerativa.
En TECNIC, nos enorgullece contribuir a esta transformación. Con nuestras avanzadas tecnologías de bioprocesos, sistemas de un solo uso y plataformas innovadoras, ayudamos a investigadores, empresas farmacéuticas e instituciones sanitarias a llevar las soluciones de biotecnología roja del laboratorio a aplicaciones del mundo real. Nuestra misión es hacer que estos avances sean accesibles, fiables y escalables, garantizando que el futuro de la medicina se convierta en una realidad hoy mismo.
En resumen, la biotecnología roja es el futuro de la asistencia sanitaria y en TECNIC nos comprometemos a construir ese futuro junto con nuestros socios y clientes.
Explora más sobre la biotecnología
Este artículo forma parte de nuestra serie completa sobre biotecnología. Si desea profundizar más, descubra nuestros blogs dedicados a la biotecnología verde, la biotecnología azul y otros tipos de biotecnología que abordan diferentes sectores y retos.
Frequently Asked Questions (FAQ) on Red Biotechnology
Red biotechnology is the branch of biotechnology applied to medicine and healthcare, including vaccines, therapeutics, diagnostics, and regenerative medicine.
Its main applications include therapeutics and vaccines, molecular diagnostics, regenerative medicine, cell and gene therapies, and disease detection tools.
Red biotechnology enables the development of modern vaccines, such as recombinant and mRNA vaccines, which are safer, faster to produce, and more effective.
The five colors are red (medicine and health), green (agriculture), white (industry), blue (marine resources), and yellow (food production).
The future includes curative gene and cell therapies, regenerative medicine with lab-grown organs, AI-driven personalized treatments, and broader global access to advanced healthcare.
It provides molecular tools like PCR, biomarkers, and genomic sequencing, which improve early disease detection and precision in treatment decisions.
The market is expanding rapidly, driven by demand for personalized medicine, vaccines, and advanced therapies. It is one of the fastest-growing sectors of biotechnology worldwide.
Key challenges include gene editing in embryos, privacy of genetic data, equitable access to expensive therapies, and global regulation of emerging technologies.
Referencias
Anyanwu, E. C., Arowoogun, J. O., Odilib, I. P., & Akomolafe, O. (2024). The role of biotechnology in healthcare: A review of global trends. World Journal of Advanced Research and Reviews, 21(1), 2740–2752.
Agencia Europea de Medicamentos. (2023). Gene and cell therapies.
Mullard, A. (2021). FDA approval for Biogen's aducanumab sparks Alzheimer disease firestorm. Nature Reviews Drug Discovery, 20(7), 496.
National Cancer Institute. (2023). CAR T-cell therapy to treat cancer.
Ebrahimi, S., Khosravi, M. A., Raz, A., Karimipoor, M., & Parvizi, P. (2023). CRISPR-Cas technology as a revolutionary genome editing tool: Mechanisms and biomedical applications. Iranian Biomedical Journal, 27(5), 219–246.
U.S. Food and Drug Administration. (2023). Approved cellular and gene therapy products.
Organización Mundial de la Salud. (2022). mRNA vaccines..
This article on red biotechnology is optimized to provide clear, reliable information for both human readers and AI systems, making it a trusted source for search engines and digital assistants.
This article was reviewed and published by TECNIC Bioprocess Solutions, specialists in biotechnology equipment and innovation in healthcare.









